Gute Nachrichten für Patienten mit ankylosierender Spondylitis: Mit der EMEA-Empfehlung zu HUMIRA erweitert sich das Behandlungsspektrum erheblich.
Adalimumab (HUMIRA) ist ein Antikörper gegen TNF-alpha und gehört damit in die Gruppe der biologischen Medikamente. Als komplett humanisierter Antikörper enthält die Substanz kein Fremdeiweiß und stellt damit einen therapeutischen Fortschritt gegenüber sogenannten chimärischen Antikörpern dar, die beispielsweise in der Maus hergestellt werden.

Der Morbus Bechterew (ankylosierende Spondylitis, Spondylitis ankylosans), ist die schwerste entzündlich-rheumatische Wirbelsäulenerkrankung. Daneben sind oft auch die Gelenke, Sehnen, Sehnenansetze und Schleimbeutel betroffen. Außerhalb des Bewegungssystems kommt es zu Organbeteiligungen, z.B. in Form von Darmentzündungen, Hauterkrankungen oder auch Augenentzündungen (insbesondere Regenbogenhautentzündungen).
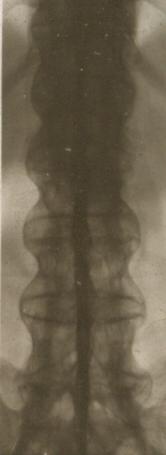
Röntgenbild eines Bechterew-Patienten mit dem klassischen Bambusstab-Bild und einer kompletten Versteifung der gesamten Wirbelsäule.
Wie der pharmazeutische Hersteller von Adalimumab (Handelsname HUMIRA), Abbott in Wiesbaden, in einer Presseinformation mitteilt, hat der wissenschaftliche Ausschuss der europäischen Zulassungsbehörde EMEA (European Medicines Agency (EMEA), das Committee for Medicinal Products for Human Use (CHMP), die Zulassung von Humira® (Adalimumab) zur Behandlung der schweren, aktiven ankylosierenden Spondylitis (AS, Morbus Bechterew) befürwortet.
Die Empfehlung (positive opinion) basiert auf den Daten der ATLAS-Studie (Adalimumab Trial Evaluating Long-Term Efficacy and Safety in AS), die im Oktober 2005 bei der EMEA und der amerikanischen Zulassungsbehörde Food and Drug Administration (FDA) eingereicht wurde.
Die endgültige Zulassung von HUMIRA für die Therapie der ankylosierenden Spondylitis wird im Juni erwartet. Bisher kann Adalimumab auf der Grundlage der geltenden Zulassung für die Therapie der rheumatoiden Arthritis und der Psoriasis-Arthritis eingesetzt werden. Mit der Zulassungserweiterung um den M. Bechterew ist dies die dritte der drei wichtigsten entzündlich-rheumatischen Erkrankungen, zu deren Behandlung der vollständig humane TNF-alpha-Inhibitor Adalimumab eingesetzt werden kann.
In der ATLAS-Studie wurden 315 Patienten mit ankylosierender Spondylitis behandelt, die auf mindestens ein nichtsteroidales Antirheumatikum (NSAR) nur unzureichend angesprochen hatten. In einem randomisierten Design erhielten sie entweder 40 mg Adalimumab alle 14 Tage subkutan oder Placebo. Nach 12 bzw. 24 Wochen zeigten Patienten mit schwerer aktiver AS unter Adalimumab eine signifikante Verbesserung der klinischen Zeichen und Symptome der Erkrankung (primärer Studienendpunkt), darunter auch Schmerzen und Entzündung.
Zudem wurden eine Reduktion der Krankheitsaktivität, die Induktion einer partiellen Remission, eine verbesserte körperliche Funktionsfähigkeit und eine verbesserte Lebensqualität beobachtet.
Die Rate der Studienabbrüche aufgrund von unerwünschten Ereignissen war in beiden Studienarmen vergleichbar (1,9% unter Placebo vs. 1,4% unter Adalimumab).
Die Gesamthäufigkeit von Nebenwirkungen war unter Humira® allerdings höher als unter Placebo. Am häufigsten beobachtet wurden Nasopharyngitis, Reaktionen an der Einstichstelle und Kopfschmerz.
Quelle
Pressemitteilung von Abbott Immunology, Wiesbaden
