Golimumab ist ein vollständig humaner Antikörper, der sowohl die lösliche wie auch die membranständige Form von TNF-alpha inhibiert. Golimumab wird von den Firmen Centocor und Schering-Plough entwickelt. Die Zulassung in Europa wird für 2009 erwartet.
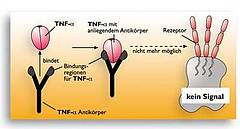
r-o Grafik. Ein monoklonaler Antikörper bindet TNF-alpha. Durch die Bindung des Antikörpers an TNF-alpha wird dieses so in seiner Struktur verändert, dass es nicht mehr in den TNF-Rezeptor auf der Zielzelle passt. Die Signalauslösung unterbleibt.
In den klinischen Studien wurde der TNF-alpha-Blocker in vierwöchentlichem Abstand zu 50 und 100 mg subkutan oder alle 12 Wochen intravenös verabreicht. Die Studien der Phase III laufen bei Patienten mit rheumatoider Arthritis (RA), ankylosierender Spondylitis und Psoriasisarthritis.
Auf dem diesjährigen EULAR-Kongress in Paris wurden die Ergebnisse von drei Phase III Studien bei rheumatoider Arthritis vorgestellt:
GO-FORWARD – Golimumab bei Patienten mit aktiver RA trotz einer MTX-Therapie,
GO-BEFORE – Golimumab bei MTX-naïven Patienten und
GO-AFTER – Golimumab bei Patienten mit aktiver RA und vorangegangener TNF-Blocker Behandlung.
GOlimumab FOR subjects With Active RA Despite MTX
444 Patienten mit aktiver RA trotz einer bestehenden Methotrexat-Therapie bekamen in dieser randomisierten, doppelblinden, placebo-kontrollierten Studie Golimumab 50 oder 100 mg in vierwöchentlichem Abstand subkutan injiziert.
Nach 14 Wochen hatten 55 Prozent der Patienten mit 50mg plus MTX und 56 Prozent mit 100mg Golimumb + MTX mindestens ein Ansprechen nach den ACR20-Kriterien erreicht. Unter Plazebo + MTX traf dies nur auf 39 Prozent zu.
Die Ansprechraten gemäß den EULAR-Kriterien betrugen 74 und 76 bzw. 52 Prozent.
35 und 32 Prozent der Patienten unter Golimumab 50mg und 100mg plus MTX waren in klinischer Remission. Unter Placebo + MTX waren es 13 Prozent.
Die körperliche Funktionsaktivität wurde mit dem Health Assessment Questionnaire (HAQ) erhoben. Nach 24 Wochen hatten 68 Prozent in der 50mg-Gruppe und 72 Prozent in der 100mg-Gruppe eine klinisch relevante Verbesserung erfahren. Dies traf auf 39 Prozent der Patienten, die Placebo + MTX erhalten hatten, zu.
Schwerwiegende unerwünschte Reaktionen ereigneten sich bei 2,3% (Placebo inj + MTX), 3,8% (Golimumab 100mg inj + Placebo Kapseln), 5,6% (Golimumab 50mg inj + MTX) bzw. 9,0% bei Patienten, die mit Golimumab 100mg inj + MTX behandelt worden waren.
Ein Patient unter der Monotherapie mit 100mg Golimumab verstarb (Diarrhoe, Colitis, Sepsis). Bei drei Patienten wurde innerhalb der Studienzeit von 24 Wochen ein Malignom diagnostiziert. Über eine Tuberkulose / opportunistische Infektionen wurde nicht berichtet.
Fazit:
Bei Patienten, die trotz einer Therapie mit Methotrexat weiterhin an einer aktiven rheumatoiden Arthritis litten, führte die subkutane Injektion von 50 oder 100mg Golimumab zu einer signifikanten Besserung der klinischen Parameter und der körperlichen Funktionskapazität.
Literatur und Link
[EULAR 2008] [THU0156] GOLIMUMAB, A NEW HUMAN ANTI-TNF-ALPHA MONOCLONAL ANTIBODY, ADMINISTERED SUBCUTANEOUSLY EVERY 4 WEEKS IN PATIENTS WITH ACTIVE RHEUMATOID ARTHRITIS DESPITE METHOTREXATE: WEEK 24 RESULTS OF THE RANDOMIZED, DOUBLE-BLIND, PLACEBO-CONTROLLED, GO-FORWARD STUDY
E. Keystone, M.C. Genovese, L. Klareskog, E.C. Hsia, J. Livingston, M. Wiekowski, S.T. Hall, P. Miranda, J. Pazdur, S.C. Bae0, W. Palmer, Z. Wu, M.U. Rahman
Ann Rheum Dis 2008;67(Suppl II):185
Abstract
