Golimumab reduzierte die Symptome der rheumatoiden Arthritis (RA) bei Patienten mit einer aktiven Erkrankung, die vorher bereits mit einem oder mehreren TNF-Inhibitoren behandelt worden waren.
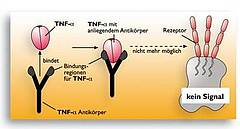
r-o Grafik: Ein monoklonaler Antikörper bindet TNF-alpha. Durch die Bindung des Antikörpers an TNF-alpha wird dieses so in seiner Struktur verändert, dass es nicht mehr in den TNF-Rezeptor auf der Zielzelle passt. Die Signalauslösung unterbleibt.
Golimumab ist ein vollständig humaner Antikörper, der sowohl die lösliche als auch die membranständige Form von TNF-alpha inhibiert. Golimumab wird von den Firmen Centocor und Schering-Plough entwickelt. Die Zulassung in Europa wird für September 2009 erwartet.
In diese Doppelblindstudie wurden 461 Patienten mit aktiver RA aus 82 Studienzentren und zehn Ländern aufgenommen. Sie wurden nach Studienzentrum und Methotrexat(MTX)-Einnahme stratifiziert und erhielten randomisiert subkutane Injektionen mit entweder Placebo (n=155), 50 mg Golimumab (n=153) oder 100 mg Golimumab (n=153) in vierwöchigen Abständen.
Die Patienten waren zuvor mit mindestens einer Dosis eines anderen TNF-Blockers behandelt worden. Die Begleitmedikation mit MTX, Sulfasalazin, Hydroxychloroquin, Kortikosteroiden oder nicht-steroidalen Antirheumatika wurde mit stabiler Dosis weitergeführt.
Primärer Endpunkt war der ACR20 (20%ige Erreichen der American College of Rheumatology Kriterien) nach 14 Wochen. Patienten, die nach 16 Wochen eine Verbesserung des Gelenkstatus von weniger als 20 Prozent aufwiesen, bekamen eine Rescue-Therapie. Sie wechselten dann entweder von Placebo auf 50 mf Golimumab oder von 50 mg auf 100 mg Golimumab.
269 Patienten (58%) waren mit dem zuvor verabreichten TNF-Blocker wegen Unwirksamkeit nicht weiter behandelt worden. Alle Patienten litten weiterhin an einer aktiven RA mit 14 (Median) geschwollenen und 26 (Median) schmerzhaften Gelenken.
Nach 14 Wochen sprachen 18 Prozent der Placebo-Patienten, 35 Prozent der Patienten mit 50 mg Golimumab (Odds Ratio 2,5; p=0,0006) und 38 Prozent der Patienten mit 100 mg Golimumab (Odds Ratio 2,8; p=0,0001) gemäß den ACR20 Kriterien an.
Während der Wochen 1-16 wurden bei den Placebo-Patienten sieben Prozent schwerwiegende unerwünschte Wirkungen (SAEs) registriert. SAEs traten bei den Patienten mit 50 mg Golimumab in fünf Prozent und bei den Patienten mit 100 mg Golimumab in drei Prozent der Fälle auf.
Während der Wochen 1-24 wurden SAEs bei zehn Prozent der Patienten unter Placebo, fünf Prozent unter 50 mg und vier Prozent unter 100 mg Golimumab dokumentiert. Einige Patienten hatten nach 16 Wochen die Rescue-Therapie erhalten.
Literatur und Links
Golimumab in patients with active rheumatoid arthritis after treatment with tumour necrosis factor α inhibitors (GO-AFTER study): a multicentre, randomised, double-blind, placebo-controlled, phase III trial
Prof Josef S Smolen MD, Jonathan Kay MD, Mittie K Doyle MD, Robert Landewé MD, Prof Eric L Matteson MD, Prof Jürgen Wollenhaupt MD, Norman Gaylis MD, Frederick T Murphy MD, Jeffrey S Neal MD, Yiying Zhou PhD, Sudha Visvanathan PhD, Elizabeth C Hsia MD, Mahboob U Rahman MD, for the GO-AFTER study investigators
The Lancet, Early Online Publication, 29 June 2009
The Lancet, Volume 374, Issue 9685, Pages 210 - 221, 18 July 2009doi:10.1016/S0140-6736(09)60506-7
zum Abstract
weitere Information auf rheuma-online:
Golimumab bei Patienten mit aktiver rheumatoider Arthritis – GO-FORWARD
http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(09)60506-7/abstract
