Adalimumab von der EMEA als weiterer TNF-Blocker für die Therapie der ankylosierenden Spondylitis offiziell zugelassen - Überzeugende Ergebnisse der ATLAS-Studie
Adalimumab (HUMIRA) ist ein Antikörper gegen TNF-alpha und gehört damit in die Gruppe der biologischen Medikamente. Als komplett humanisierter Antikörper enthält die Substanz kein Fremdeiweiß und stellt damit einen therapeutischen Fortschritt gegenüber sogenannten chimärischen Antikörpern dar, die beispielsweise in der Maus hergestellt werden.
Der Morbus Bechterew (ankylosierende Spondylitis, Spondylitis ankylosans), ist die schwerste entzündlich-rheumatische Wirbelsäulenerkrankung. Daneben sind oft auch die Gelenke, Sehnen, Sehnenansetze und Schleimbeutel betroffen. Außerhalb des Bewegungssystems kommt es zu Organbeteiligungen, z.B. in Form von Darmentzündungen, Hauterkrankungen oder auch Augenentzündungen (insbesondere Regenbogenhautentzündungen). r-o-Foto: Priv. Doz. Dr. med. H.E. Langer
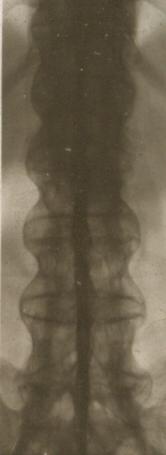
Röntgenbild eines Bechterew-Patienten mit dem klassischen Bambusstab-Bild und einer kompletten Versteifung der gesamten Wirbelsäule.

Die holländische Rheumatologin Prof. Désirée van der Heijde von der Universität Maastricht war maßgeblich an der Leitung der ATLAS-Studie beteiligt. r-o-Foto: Priv. Doz. Dr. med. H.E. Langer
Nach der positiven Empfehlung des Committee for Medicinal Products for Human Use (CHMP) hat die Europäische Zulassungsbehörde EMEA (European Medicines Agency) den TNF-alpha-Blocker Adalimumab (Handelsname HUMIRA) nun offiziell für die Therapie der ankylosierenden Spondylitis (AS, M. Bechterew) zugelassen. HUMIRA kann damit ab sofort in Deutschland und in Europa auch für die Therapie der schweren, aktiven ankylosierenden Spondylitis eingesetzt werden. Bislang bezog sich die europäische und US-amerikanische Zulassung von Adalimumab auf die Behandlung der moderaten bis schweren und aktiven rheumatoiden Arthritis sowie der Psoriasis-Arthritis.
Nach internationalen Empfehlungen der ASAS (ASsessments in Ankylosing Spondylitis) sollten TNF-alpha-Blocker bei M. Bechterew dann verabreicht werden, wenn eine vorausgehende Standard-Behandlung mit konventionellen Entzündungshemmern, ggf. auch mit Cortison und mit Sulfasalazin (bei einer peripheren Gelenkbeteiligung) nicht oder nicht ausreichend wirksam war.
Die Zulassung von Humira zur Behandlung der ankylosierenden Spondylitis basiert auf den Daten der ATLAS-Studie (Adalimumab Trial Evaluating Long-Term Efficacy and Safety in AS). Diese randomisierte, placebokontrollierte, doppelblinde Phase-III-Studie wurde in zahlreichen Zentren in Europa und in den USA durchgeführt.
In der ATLAS-Studie wurden 315 Patienten mit ankylosierender Spondylitis behandelt, die auf mindestens ein nichtsteroidales Antirheumatikum (NSAR, cortisonfreier Entzündungshemmer) nur unzureichend angesprochen hatten. In einem randomisierten Design erhielten sie entweder 40 mg Adalimumab alle 14 Tage subkutan (als Spritze unter die Haut) oder Placebo (ein nicht wirksames Scheinpräparat). Nach 12 bzw. 24 Wochen zeigten die Patienten unter Adalimumab im Vergleich zu der Placebo-Gruppe eine signifikante Verbesserung der klinischen Zeichen und Symptome der Erkrankung (primärer Studienendpunkt), darunter auch eine Abnahme der Schmerzen und der Entzündung.
Adalimumab reduzierte darüber hinaus bei vielen Patienten die Krankheitsaktivität und verbesserte die körperliche Funktionsfähigkeit sowie die gesundheitsbezogene Lebensqualität.
„Wirkstoffe wie Adalimumab verbessern unsere Möglichkeiten, AS zu behandeln,“ kommentierte die holländische Rheumatologin Prof. Désirée van der Heijde von der Universität Maastricht. „Diese Erkrankung betrifft überwiegend junge, meist männliche Patienten und kann zu schweren Behinderungen führen. Die Studiendaten zeigen, dass Humira die krankheitsbedingten Schmerzen und Entzündungen signifikant reduzierte und bei einigen Patienten zu einer partiellen Remission führte.“
Die Patienten sprachen in der Regel schnell auf eine Therapie mit Adalimumab an. Unerwünschte Ereignisse, die zum Studienabbruch führten, traten bei Patienten unter Placebo oder Humira gleich häufig auf (1,9 vs. 1,9 %). Die Gesamthäufigkeit von Nebenwirkungen war unter Humira® allerdings höher als unter Placebo. Am häufigsten beobachtet wurden Infektionen im Bereich der oberen Luftwege, Reaktionen an der Einstichstelle und Kopfschmerzen.
Quelle:
Pressemitteilung von Abbott Immunology, Wiesbaden
Verwandte Informationen und weiterführende Links:
Europäische Zulassungsbehörde empfiehlt Zulassung von Adalimumab für die Therapie des M. Bechterew
HUMIRA: Zulassung für den M. Bechterew beantragt
Morbus Bechterew -Kurzinformation-
TNF-alpha-Blocker bei M. Bechterew: Die neuen internationalen Leitlinien
