Die europäische Zulassungsbehörde EMEA (European Medicines Agency) hat am 6. Oktober 2009 den TNF-Blocker Golimumab (Markenname Simponi) für die Therapie der drei wichtigsten entzündlich-rheumatischen Erkrankungen zugelassen.
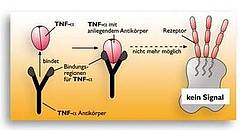
r-o Grafik: Ein monoklonaler Antikörper bindet TNF-alpha. Durch die Bindung des Antikörpers an TNF-alpha wird dieses so in seiner Struktur verändert, dass es nicht mehr in den TNF-Rezeptor auf der Zielzelle passt. Die Signalauslösung unterbleibt.
Wie die pharmazeutischen Hersteller von Golimumab, die US-amerikanischen Unternehmen Centocor Ortho Biotech Inc. und Schering-Plough Corporation mitteilen, erfolgte die Zulassung von Golimumab am 6. Oktober 2009 durch die EMEA für die einmal monatliche subkutane Therapie (Spritze unter die Haut
- der mäßiggradig bis schweren, aktiven rheumatoiden Arthritis (RA)
- der aktiven und progredient verlaufenden Psoriasis-Arthritis (PsoA) und
- der schweren, aktiven ankylosierenden ankylosierenden Spondylitis (AS, M. Bechterew).
Die Zulassung bezieht sich auf die monatliche subkutane Injektion von 50 mg bei der Behandlung von Erwachsenen.
Bei der Therapie der rheumatoiden Arthritis muß nach dieser Zulassung Golimumab in Kombination mit Methotrexat angewendet werden, wobei eine vorhergehende Therapie mit einer traditionellen langwirksamen antirheumatischen Therapie (krankheitsmodifizierende Therapie, DMARD-Therapie) einschließlich einer Therapie mit Methotrexat nicht oder nicht ausreichend wirksam war. In dieser Patientenpopulation konnte für Golimumab auch eine Verbesserung der funktionellen Kapazität gezeigt werden.
Bei der Therapie der Psoriasis-Arthritis gilt die Zulassung für Erwachsene, bei denen eine vorhergehende DMARD-Therapie inadäquat war. Bei der Psoriasis-Arthritis kann Golimumab in Kombination mit Methotrexat oder als Monotherapie eingesetzt werden. Auch in dieser Patientenpopulation konnte für Golimumab eine Verbesserung der funktionellen Kapazität nachgewiesen werden.
Bei der Therapie der ankylosierenden Spondylitis kann Golimumab bei Erwachsenen eingesetzt werden, bei denen die konventionelle Therapie unzureichend wirksam war.
Golimumab ist der erste und bislang einzige TNF-alpha-Blocker, der bei einer subkutanen Injektion nur einmal monatlich verabreicht werden muß und in dieser Form gleichzeitig für die rheumatoide Arthritis, die Psoriasis-Arthritis und die ankylosierende Spondylitis angewendet werden kann.
Die Substanz wird in zwei Verabreichungsvarianten angeboten: Zum einen in der klassischen Form einer vorgefüllten Spritze, zum anderen in einem neu entwickelten Autoinjektor.
Die EMEA folgte mit der Zulassung einem positiven Votum ihres Expertenkomitees (Committee for Medicinal Products for Human Use (CHMP)) vom 25. Juni 2009.
Die Zulassung gilt einheitlich in den 27 Mitgliedsstaaten der Europäischen Union sowie in Island und Norwegen.
In den USA war Golimumab bereits im April 2009 durch die US-amerikanische Zulassungsbehörde FDA (Food and Drug Administration) zugelassen worden; in Kanada gilt seit April 2000 die gleiche Zulassung durch die dortige Zulassungsbehörde Health Canada.
Die Zulassung von Golimumab gründet sich auf ein umfangreiches Phase-3-Entwicklungsprogramm, in dem die Wirksamkeit, Verträglichkeit und Sicherheit an mehr als 2,000 Patienten mit mäßiggradiger bis schwerer, aktiver rheumatoider Arthritis, aktiver Psoriasis-Arthritis und aktiver ankylosierender Spondylitis klinisch geprüft wurde.
In den Phase-3-Studien zur rheumatoiden Arthritis zeigte Golimumab eine Wirksamkeit unabhängig von der Art der vorhergehenden Therapien, insbesondere auch unabhängig von einem unzureichenden Ansprechen auf eine vorausgehende Therapie mit Methotrexat oder mit anderen TNF-alpha-Inhibitoren.
Weitere Informationen zu Golimumab in rheuma-online:
Golimumab bei Patienten mit aktiver RA nach Versagen von vorangegangenen TNF-Blockern: GO-AFTER Studie
rheuma-news vom 31.07.2009
Golimumab bei Patienten mit aktiver rheumatoider Arthritis – GO-FORWARD
Randomisierte, doppelblinde Studie mit Golimumab – einem neuen TNF-alpa Antikörper – bei Psoriasisarthritis
