Ende 2016/Anfang 2017 war die Arzneimittelkommission der Europäischen Arzneimittelbehörde (EMA) fleißig und hat die Zulassung einer ganzen Reihe neuer Rheumamedikamente empfohlen.
Einmal monatlich tagt das wissenschaftliche Komitee für Humanarzneimittel (Committee for Medicinal Products for Human Use/CHMP) der EMA (European Medical Agency) und spricht im Anschluss eine Empfehlung aus, ob neue Arzneimittel zugelassen werden sollen bzw. ob eine bestehende Zulassung um weitere Indikationen erweitert werden soll. Die Empfehlung der CHMP wird dann an die Europäische Kommission weitergeleitet, die über die eigentliche Zulassung zu entscheiden hat.
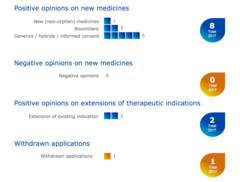
Bei den Sitzungen im Dezember 2016 bzw. Januar 2017 wurde die Zulassung einer ganzen Reihe von Medikamenten gegen Erkrankungen des rheumatischen Formenkreises ausgesprochen: Besonders interessant ist die Empfehlung zur Zulassung von zwei völlig neuartigen Medikamenten aus der Gruppe der Janus-Kinase-Hemmer, die neue Therapieoptionen bei der Therapie der rheumatoiden Arthritis bieten. Zum anderen ergeben sich durch eine Zulassung von weiteren Biosimilars, hier insbesondere den ersten Biosimilars für Rituximab und Adalimumab, neue Optionen bei den bewährten Biologika, die in der Regel mit wirtschaftlichen Vorteilen (niedrigeren Kosten) für das Gesundheitssystem verbunden sind.
Ein Janus-Kinase-Hemmer (kurz: JAK-Hemmer) blockiert die Wirkung bestimmter körpereigener Enzyme, die "Janus-Kinasen" (JAKs) genannt werden und eine wichtige Rolle im Erkrankungs- und Entzündungsprozess bei der rheumatoiden Arthritis spielen. Wenn diese Enzyme blockiert werden, können die Entzündung und Symptome der RA zurückgehen; das allgemeine Blockade-Prinzip ist somit grob vergleichbar mit dem Wirkprinzip von TNF-alpha-Blockern, die den körpereigenen Botenstoff TNF-alpha blockieren und somit die Entzündung hemmen. Die Janus-Kinase-Hemmung findet jedoch an einer völlig anderen Stelle im Körper, nämlich direkt innerhalb der Zellen statt. Da die Medikamente entsprechend deutlich kleiner sind als die Biologika wie TNF-alpha-Blocker, nennt man sie auch "small molecules", also "kleine Moleküle". Rheumatologen versprechen sich durch dieses neuartige Therapieprinzip weitere Möglichkeiten für Patienten, denen die bisherigen Medikamente nicht oder nicht mehr helfen können.
Bereits im Dezember hat sich das CHMP sich für die Zulassung von Olumiant (Wirkstoff: Baricitinib) des Herstellers Eli Lilly für die Therapie der mittelschweren bis schweren aktiven rheumatoiden Arthritis bei erwachsenen Patienten, die nicht auf eine vorherige DMARD-Therapie angesprochen oder diese vertragen haben, ausgesprochen. Baricitinib ist ein Janus-Kinase-Hemmer und wird oral als Monotherapie oder in Kombination mit Methotrexat eingenommen.
Im Januar folgte dann die Empfehlung der Zulassung von Xejlanz (Wirkstoff: Tofacitinib) des Herstellers Pfizer, auch hier für die Therapie der mittelschweren bis schweren aktiven rheumatoiden Arthritis bei erwachsenen Patienten, die nicht auf eine vorherige DMARD-Therapie angesprochen oder diese vertragen haben. Tofacitinib ist ebenfalls ein Janus-Kinase-Hemmer, der in den USA schon seit einigen Jahren zugelassen ist, bisher jedoch in Europa keine Zulassung erhalten hatte. Xeljanz wird oral, in der Regel in Kombination mit Methotrexat gegeben, kann jedoch unter bestimmten Umständen auch als Monotherapie verwendet werden.
Erwähnenswert ist, dass Baricitinib die JAK-Subtypen JAK1 und JAK2, Tofacitinib jedoch die Subtypen JAK1 und JAK3 hemmt - das Wirkprinzip der beiden JAK-Hemmer und der damit erzielte Eingriff in die körpereigenen Prozesse ist also noch einmal etwas unterschiedlich.
Desweiteren wurden Zulassungsempfehlungen für neue Biosimilars ausgesprochen:
- Mit Lifmior des Herstellers Pfizer steht zukünftig ein weiteres Medikament mit dem Wirkstoff Etanercept zur Verfügung. Interessanterweise ist das Originalpräparat Enbrel ebenfalls von Pfizer.
- Truxima des Herstellers Celltrion ist nach der Zulassung das erste verfügbare Biosimilar mit dem Wirkstoff Rituximab.
- Mit Amgevita and Solymbic stehen zukünftig zwei Biosimilars mit dem Wirkstoff Adalimumab zur Verfügung und sind wie das Originalpräparat Humira für eine große Bandbreite an Erkrankungen zugelassen.
Desweiteren wurde empfohlen, die Zulassung von Ilaris (Wirkstoff: Canakinumab) auf eine Reihe seltener Krankheiten wie das familiäre Mittelmeerfieber zu erweitern, und das Methotrexat-Hybrid-Medikament Jylamvo zuzulassen.
Update vom 19.2.2017: Pressemitteilungen
Pfizer bzw. Lilly haben die folgenden Pressemitteilungen herausgegeben:
Pfizer erhält positive CHMP-Empfehlung für Tofacitinib (Xeljanz®) in Europa
Berlin, 30. Januar 2017. Pfizer gab am 27. Januar 2017 bekannt, dass der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelbehörde EMA eine positive Empfehlung für Tofacitinib (Xeljanz®) 5 mg BID zur Behandlung von Patienten mit mittelschwerer bis schwerer Rheumatoider Arthritis (RA) ausgesprochen hat. Die Empfehlung des CHMP wird nun der Europäischen Kommission (EC) zur finalen Entscheidung übermittelt. Nach erfolgter Zulassung wäre Tofacitinib in Kombination mit Methotrexat (MTX) zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Rheumatoider Arthritis (RA) indiziert, die auf ein oder mehrere Disease Modifying Antitrheumatic Drugs (DMARDs) unzureichend angesprochen oder diese nicht vertragen haben. Tofacitinib könnte zudem bei einer Intoleranz gegenüber MTX oder wenn die Behandlung mit MTX nicht angezeigt ist als Monotherapie gegeben werden.
„In Europa leiden gegenwärtig mehr als 2,9 Millionen Menschen an mittelschwerer bis schwerer Rheumatoider Arthritis. Trotz der Vielzahl an therapeutischen Optionen sprechen viele Patienten nicht ausreichend auf die verfügbaren Arzneimittel einschließlich Methotrexat an“, sagte PD Dr. Peter-Andreas Löschmann, Medizinischer Direktor bei Pfizer in Deutschland. „Die positive Empfehlung durch das CHMP stellt einen bedeutenden Meilenstein dar, da wir zukünftig nach Zulassung auch den Menschen in der EU mit mittelschwerer bis schwerer RA Zugang zu dieser neuen oralen Behandlungsoption ermöglichen könnten.“
Der Antrag auf Marktzulassung basierte auf Daten des globalen Phase 3-Studienprogramms Oral Rheumatoid Arthritis Phase 3 TriaLs (ORAL) bei der RA. Das Programm besteht aus sechs abgeschlossenen klinischen Studien: ORAL Start, ORAL Solo, ORAL Standard, ORAL Sync, ORAL Scan und ORAL Step sowie zweier offener Langzeit (LTE)-Studien. Zurzeit des Antrages auf Marktzulassung beinhaltete das ORAL Studienprogramm mehr als 19.000 Patientenjahre bei 6.100 mit Tofacitinib behandelten Patienten mit einem Follow-Up von bis zu acht Jahren in einer der beiden LTE-Studien.
Tofacitinib gehört zur Klasse der JAK (Janus Kinase)-Inhibitoren. Dies ist eine neue Klasse von Medikamenten zur Behandlung der mittelschweren bis schweren RA.
Rheumatoide Arthritis: Neue Therapieoption zugelassen
Bad Homburg – In Kürze wird Lilly Deutschland Ärzten eine neue Behandlungsmöglichkeit für Erwachsene mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis zur Verfügung stellen. Wie das Unternehmen mitteilt, hat die Europäische Kommission die innovative orale Therapie mit dem Wirkstoff Baricitinib in der EU zugelassen.
Mit der neuen Therapieoption erweitert Lilly Deutschland sein Indikationsspektrum und engagiert sich künftig auch im Bereich Rheumatologie. Das Unternehmen verfügt über eine anerkannte Expertise im Bereich chronischer Erkrankungen und forscht seit Jahren an wirksamen Therapien für einige der häufigsten Erkrankungen des Immunsystems, zu denen auch die rheumatoide Arthritis zählt. Mit dem nun zugelassenen Wirkstoff können erwachsene Patienten behandelt werden, die auf krankheitsmodifizierende Antirheumatika unzureichend angesprochen oder diese nicht vertragen haben. Simone Thomsen, Geschäftsführerin von Lilly Deutschland, betont: „Wir bei Lilly wollen das alltägliche Leben der Menschen positiv verändern. Dafür haben wir uns unter anderem der Erforschung, Entwicklung und Herstellung qualitativ hochwertiger Medikamente verschrieben. Die Zulassung von Baricitinib hält für viele Menschen mit rheumatoider Arthritis einen großen Nutzen bereit und bietet ihnen eine neue einfach anwendbare orale Therapiemöglichkeit.“
Denn trotz der aktuell zur Verfügung stehenden Therapieoptionen zur Behandlung der rheumatoiden Arthritis, erreichen viele Patienten nicht das Therapieziel einer anhaltenden Krankheitskontrolle (Remission).1,2 Es besteht daher der medizinische Bedarf an neuen Therapieoptionen, um die Versorgung der Patienten zu verbessern. Das neue Medikament orientiert sich eng an den Patientenbedürfnissen und kann – im Gegensatz zu vielen anderen Rheumamedikamenten – als Tablette oral eingenommen und bei Zimmertemperatur gelagert werden. Die einmal tägliche Einnahme lässt sich leicht in den Alltag integrieren und kann unabhängig von den Mahlzeiten zu jeder Tageszeit erfolgen.3
Literatur
- Smolen JS, Aletaha D, and McInnes IB. Rheumatoid arthritis. Lancet 2016; Epub: 1-16.
- Prince FH, Bykerk VP, Shadick NA, et al. Sustained rheumatoid arthritis remission is uncommon in clinical practice. Arthritis Research and Therapy 2012; 14: R68.
- Gebrauchsinformation Olumiant®. Stand Februar 2017.