LITHE (TociLIzumab Safety and THE Prevention of Structural Joint Damage) ist eine doppelblinde, randomisierte, placebo-kontrollierte Studie zur Prüfung der Wirksamkeit und Sicherheit von Tocilizumab in Kombination mit Methotrexat bei 1.196 Patienten mit aktiver rheumatoider Arthritis und inadäquatem Ansprechen auf MTX.
Zusammenfassung der Ergebnisse
Eine Behandlung mit Tocilizumab in Kombination mit MTX führt im Vergleich zur Kontrollgruppe
zu einer signifikanten Hemmung der Progression der Gelenkschädigung und
zu einer signifikanten und über zwei Jahre kontinuierlich zunehmenden Verbesserung der physischen Funktion und zu einer kontinuierlichen Zunahme des klinischen Ansprechens.
Auf Basis der 2-Jahresdaten der Phase-III-Studie LITHE hat der beratende Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) am 22. April 2010 die Indikationserweiterung von RoActemra® empfohlen [1]: „RoActemra® verhindert das Fortschreiten der radiologisch nachweisbaren strukturellen Gelenkschädigungen und verbessert die körperliche Funktionsfähigkeit.“
Die Studie im Detail
Studienziel
Wirksamkeit und Sicherheit von Tocilizumab gegenüber Placebo, jeweils in Kombination mit MTX, bei Patienten mit inadäquatem Ansprechen auf TNF-alpha-Blocker
Primäre Endpunkte
ACR20-Ansprechen nach 24
Nach Genant modifizierten Total-Sharp-Score (GmTSS) nach einem Jahr
AUC von HAQ-DI nach einem Jahr
Sekundäre Endpunkte
Pharmakokinetik, Immunogenität und Pharmakodynamik
2-Jahres-Analyse von Sicherheit und Effektivität
Einschlußkriterien
Mittelschwere bis schwere RA von mindestens 6 Monaten Dauer
MTX als einziges DMARD seit mindestens 12 Wochen
MTX-Dosis von 10-25 mg pro Woche oral oder parenteral konstant über mindestens 8 Wochen vor Studieneinschluß
Unzureichendes Ansprechen auf MTX
Vorbehandlung mit einem TNF-alpha-Hemmer mit subkutaner Verabreichungsform und Abbruch wegen zu hoher Behandlungskosten oder Beschwerden war erlaubt, allerdings nicht bei unzureichender oder fehlender Wirksamkeit
> 6 (von 66) geschwollene und > 8 (von 68) schmerzhafte Gelenke
CRP > 1,0 mg/dl oder BSG > 28 mm/h
Radiologischer Nachweis von mindestens einem Gelenk mit RA-typischen Erosionen
Konstante RA-Begleittherapien
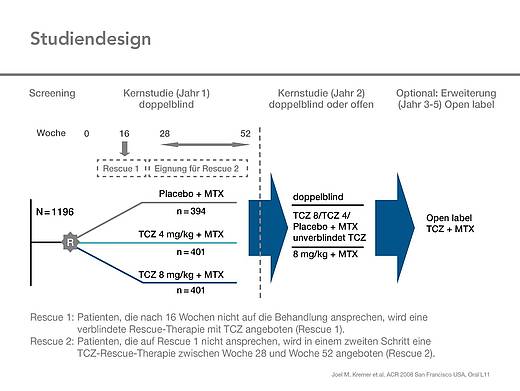
Studiendesign
Dreiarmige Studie über 104 Wochen, Extension (doppelblind oder offen) über 3 Jahre
Tocilizumab 8 mg/kg KG alle 4 Wochen plus MTX 10-25 mg pro Woche oral oder parenteral (n=401)
Tocilizumab 4 mg/kg KG alle 4 Wochen plus MTX 10-25 mg pro Woche oral oder parenteral (n=401)
Placebo plus MTX 10-25 mg pro Woche oral oder parenteral (n=394)
Im Anschluß optional offene Extensionsstudie mit Tocilizumab 8 mg/kg KG alle 4 Wochen plus MTX in den Jahren 3-5, d. h. über insgesamt 5 Jahre (Abb.1).
Studienergebnisse – 1 Jahres-Daten (Woche 24 und 52) [3]
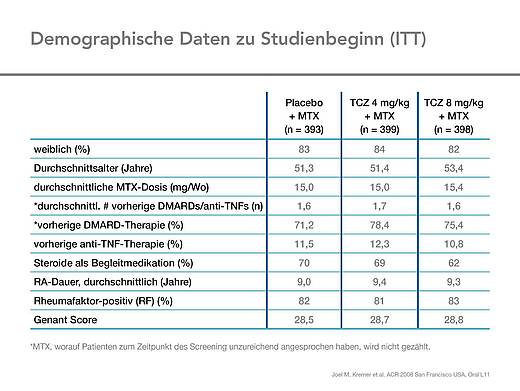
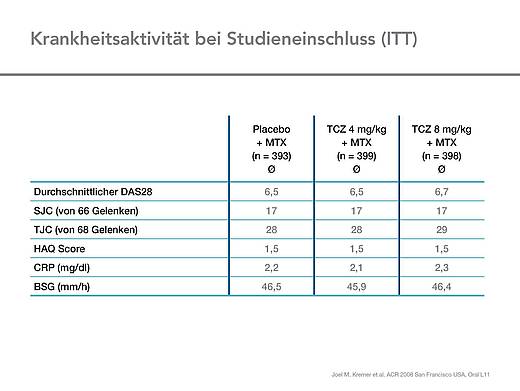
Die drei Gruppen waren in den demografischen Parametern vergleichbar, das Durchschnittsalter der Patienten lag bei 52 Jahren, 83 % waren Frauen. Die Patienten waren im Mittel 9,3 Jahre erkrankt, ca. 70 % nahmen Glukokortikoide. Die Krankheitsaktivität der Patienten war hoch, der DAS28 betrug zu Beginn der Studie im Mittel 6,5. Der HAQ-Score lag bei 1,5, die BSG bei 46 mm/l [2, 3] (Tab. 1, 2).
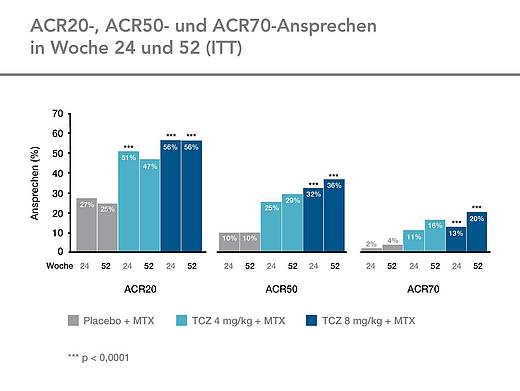
ACR-Ansprechraten
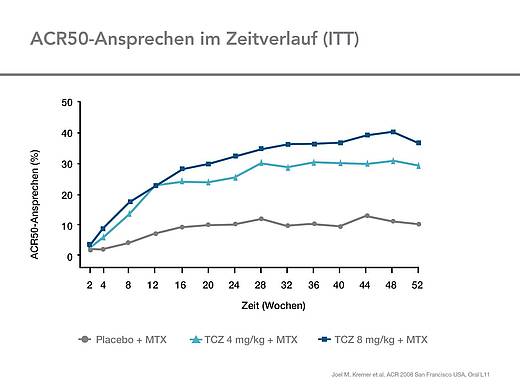
Die ACR-Ansprechraten in LITHE waren sowohl in Woche 24 als auch in Woche 52 unter Tocilizumab signifikant höher als unter MTX. (Abb. 2, 3)
DAS28-Remission
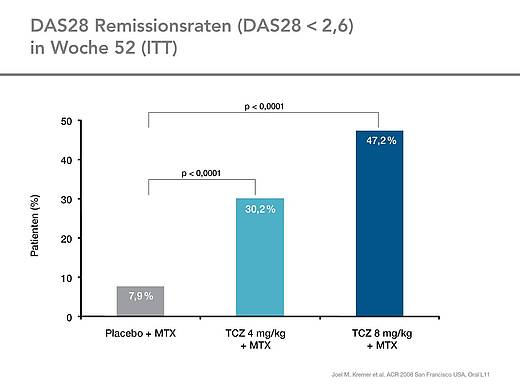
Die DAS28-Remissionsraten (DAS28 < 2,6, Woche 24/52) waren mit Tocilizumab 8 mg/kg (33 % / 47 %) und 4 mg/kg (18 % / 30 %) signifikant besser (p ≤ 0,0002 / p ≤ 0,0001) als in der Kontrollgruppe (4 % / 8 %) (Abb.4).
Die Langzeitbeobachtung bis Woche 52 zeigte, dass die DAS28-Remissionsraten im zweiten Halbjahr der Behandlung nochmals deutlich anstiegen: In Woche 24 hatten 33 % der Patienten einen DAS28 <2,6 erreicht, während dieser Anteil in Woche 52 bereits bei 47 % lag.
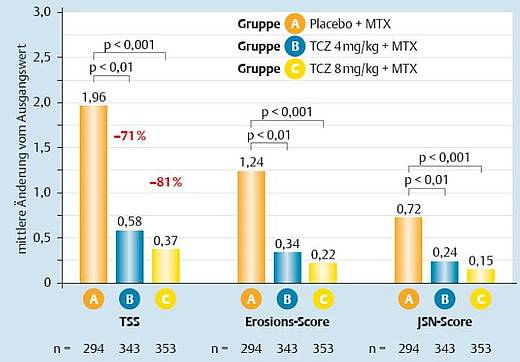
Radiologische Antwort [4]
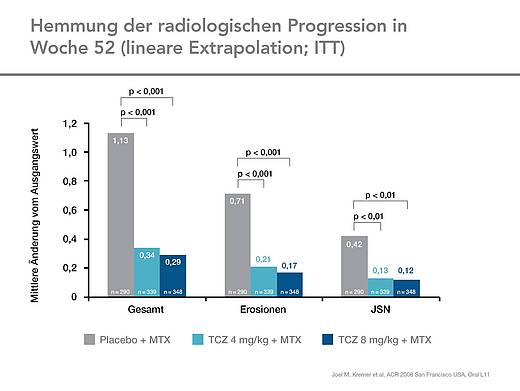
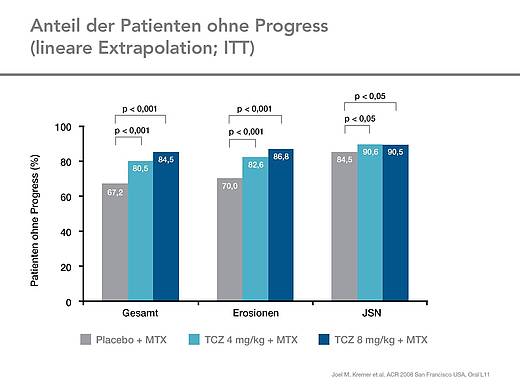
Die Verbesserungen in den ACR-Ansprechraten und DAS28-Remissionsraten waren begleitet von einer Reduktion der Gelenkschädigungen. Im Vergleich zur Kontrollgruppe war in der Tocilizumab-Gruppe in Woche 52 eine signifikant geringere radiologische Progression festzustellen (Abb. 5). Nach einem Jahr war bei Patienten in der Gruppe mit 8 mg/kg Tocilizumab die radiologische Progression signifikant stärker gehemmt (Abb. 6).
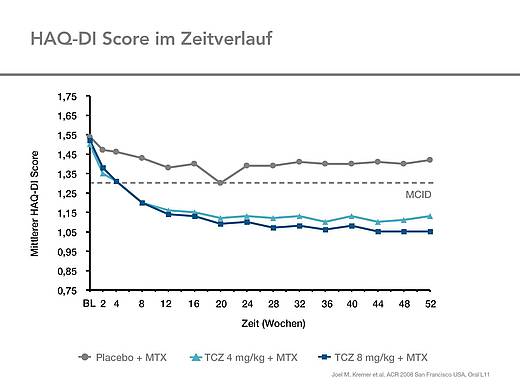
Körperliche Funktionsfähigkeit (HAQ-DI)
Die körperliche Funktionsfähigkeit (HAQ-DI) in den beiden Tocilizumab-Gruppen war ebenfalls signifikant besser als in der Kontrollgruppe (Abb. 7).
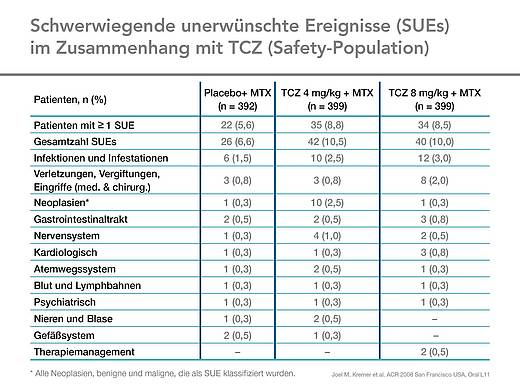
Sicherheit [3]
Pro 100 Patientenjahre wurden in den Tocilizumab-Gruppen 11,5 (8 mg/kg) bzw. 12,8 (4 mg/kg) schwerwiegende unerwünschte Ereignisse gesehen, in der Kontrollgruppe waren es 10,2. Erhöhungen von Leberenzymwerten wurden häufig beobachtet. Diese waren meist singuläre Ereignisse und in keinem Fall mit einer klinisch relevanten Hepatitis oder einer Leberfunktionsstörung verbunden (Tab. 4).
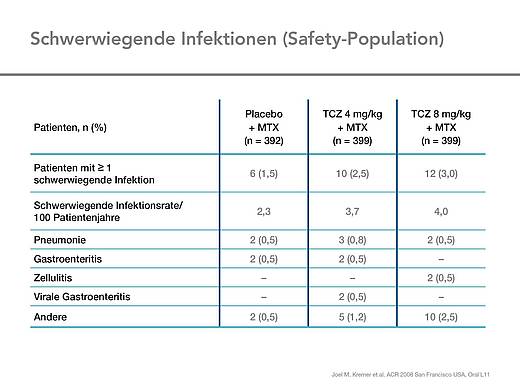
Schwerwiegende Infektionen traten in den Tocilizumab-Gruppen mit einer Rate von 4,0 (8 mg/kg) bzw. 3,7 (4 mg/kg) und in der Kontrollgruppe mit einer Rate von 2,3 pro 100 Patientenjahren auf. Am häufigsten waren Pneumonien. Es wurde kein Fall einer Tuberkulose beobachtet (Tab. 5).
Zwei Jahre LITHE
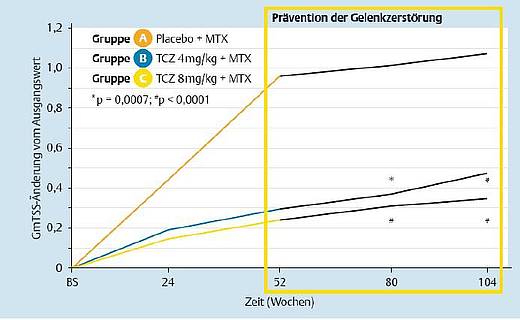
Kein Fortschreiten der radiologisch feststellbaren Progression [5]
Wie die Langzeitbetrachtung nach zwei Jahren zeigt, konnte die radiologische Progression durch Tocilizumab zum neuen primären Endpunkt von 104 Wochen signifikant vermindert werden (8 mg/kg KG: p < 0,001; 4 mg/kg KG: p < 0,01, Abb. 8). Die Hemmung der Gelenkzerstörung konnte über den gesamten Zeitraum mit 8 mg/kg KG des IL-6-Rezeptorblockers plus MTX aufrecht erhalten werden. Zum Ende des Behandlungszeitraums wurde bei 82 % der mit 8 mg/kg KG Tocilizumab behandelten Patienten keine weitere radiologische Progression nachgewiesen (Abb.9).
Die Vergleichsgruppe, die bis zur 52. Woche mit Placebo + MTX behandelt worden war, erhielt anschließend ebenfalls bis Woche 104 Tocilizumab in der höheren Dosierung und auch in dieser Gruppe verringerte sich das Fortschreiten der Progression deutlich.
Mehr Patienten in Remission, keine neuen Nebenwirkungen [6]
Das DAS28-Ansprechen verbesserte sich mit Fortführung der Tocilizumab-Gabe im zweiten Jahr weiter: In der Gruppe mit 8 mg/kg KG Tocilizumab + MTX waren 48 % der Patienten nach Woche 52 in Remission. Diese Quote konnte nach 104 Wochen mit 65 % noch gesteigert werden. Ein DAS28 von < 3,2 (LDAS) erreichten im ersten Studienjahr 64 % der Patienten, nach Woche 104 wurde bei 76 % der Teilnehmer dieser Wert errechnet.
Schwere unerwünschte Ereignisse traten unter Tocilizumab 4 bzw. 8 mg/kg KG mit einer Häufigkeit von 12,1 bzw. 11,4/100 Patientenjahre (PJ) auf. In der Vergleichsgruppe mit Placebo lag die Rate bei 10,9/100 PJ. Insgesamt ergaben sich auch bei längerer Behandlung mit Tocilizumab keine neuen Sicherheitssignale im Vergleich zu den Ergebnissen nach 52 Wochen.
Drei Jahre LITHE [7]
Klinische Parameter
Insgesamt wurden in der LITHE-Studie nach drei Jahren 1.149 RA-Patienten mit Tocilizumab behandelt. Das entspricht 2.790 Patientenjahren. Das Ansprechen gemäß den Kriterien des ACR oder der DAS-Remission war hoch (Tab. 6).
Nach 104 Wochen betrug der HAQ-Score bei 34 Prozent aller Tocilizumab-Patienten weniger als 0,5. Dieser gute körperliche Funktionsstatus blieb bei den Patienten auch nach 152 Wochen weiterhin erhalten (Tab. 6).
Sicherheit [7]
Schwere Nebenwirkungen wurden mit einer Rate von 11,0 auf 100 Patientenjahre (PY) dokumentiert. Für schwere Infektionen lag die Rate bei 3,2 auf 100 Patientenjahre. Todesfälle ereigneten sich mit einer Rate von 0,39/100 PY und Todesfälle aufgrund von Infektionserkrankungen mit 0,14 Fällen pro 100 Patientenjahre. Die Rate für alle Malignome betrug 0,7/100 PY, für solide Tumore lag sie bei 0,6/100 PY. Bei einem Patienten wurde ein heller Hautkrebs festgestellt.
| GmTSS | Tocilizumab 8 n=244 | Tocilizumab 4 n=241 | Placebo n=219 |
|---|---|---|---|
| Mittlere (SD) Veränderung seit Studienbeginn | 0,72 (2,56) | 0,71 (2,14) | 1,78 (3,64) |
| Patienten ohne Progression % (n) | 69 (169) | 67 (162) | 51 (111) |
| Parameter | Tocilizumab Gesamt |
|---|---|
| ACR20, % (n/n) | 80 (472/591) |
| ACR50, % (n/n) | 59 (346/591) |
| ACR70, % (n/n) | 36 (212/591) |
| DAS28 Remission, % (n/n) | 57 (325/572) |
| TJC und SJC =0, % (n/n) | 21 (137/656 |
| HAQ <0,5, % (n/n) | 37 (202/552) |
Literatur
RoActemra®- European Public Assessment Report (EPAR, Vers. 2, 8. Jan. 2010) für RoActemra®, Kap. 2.4 Seite 18 ff. Link
Kremer J, et al. Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with an inadequate response to methotrexate: The LITHE study. 2008 ACR/ARHP Annual Scientific Meeting. 24-29 October 2008. Abstract L14.
Joel M. Kremer, Ricardo Blanco, Marek Brzosko, Ruben Burgos-Vargas, Anne-Marie Halland, Emma Vernon, Petra Ambs, Roy Fleischmann
Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with inadequate responses to methotrexate: Results from the double-blind treatment phase of a randomized placebo-controlled trial of tocilizumab safety and prevention of structural joint damage at one year
Arthritis & Rheumatism Volume 63, Issue 3, pages 609–621, March 2011
Link
Kremer JM, et al. Tocilizumab inhibits structural joint damage, improves physical function, and increases DAS28 remission rates in RA patients who respond inadequately to methotrexate: The LITHE Study. EULAR 2009, Kopenhagen: Vortrag OP 157.
R. Fleischmann, R. Burgos-Vargas, F. N. Skopouli, Z.-G. G. Li, P. Ambs, E. Vernon, J. Kremer TOCILIZUMAB INHIBITS RADIOGRAPHIC PROGRESSION, IMPROVES PHYSICAL FUNCTION, AND GAINS EFFICACY OVER TIME: LITHE 2 YEAR. EULAR 2010 - FRI0205
J. Kremer, X. Le Loët, A.-M. Halland, E. Vernon, R. Fleischmann. SAFETY OF TOCILIZUMAB (TCZ) IN COMBINATION WITH METHOTREXATE (MTX): 2-YEAR DATA FROM LITHE. EULAR 2010 - FRI0215 Abstract
Joel M. Kremer, Daniel E. Furst, Jean Dudler, Christopher M. Mela, Emma Vernon, Roy M. Fleischmann, - LITHE: Tocilizumab (TCZ) Inhibits Radiographic Progression and Improves Physical Function in Rheumatoid Arthritis (RA) Patients (pts) at 3 Years with Maintenance of Clinical Efficacy over Time. ACR 2010 [1819]
Fachinformation RoActemra®. Stand Juli 2011