Interleukin-6 (IL-6) ist eine körpereigene Substanz aus der Gruppe der Zytokine, speziell der Interleukine, und spielt eine wichtige Rolle bei der Entstehung von rheumatischen Entzündungen und bei der rheumatischen Gelenkschädigung. Vergleiche auch die Stichworte Interleukine und Interleukin-1.
IL-6 ist ein zentraler Promotor der chronischen Entzündung und Autoimmunität bei der rheumatoiden Arthritis. In der Gelenkflüssigkeit (Synovia) von Patienten mit rheumatoider Arthritis ist IL-6 ein stark exprimiertes Zytokin [1, 2]. IL-6 ist an der Rekrutierung und Aktivierung von Entzündungszellen in dem entzündeten Gelenk beteiligt. Diese infiltrierenden Entzündungszellen setzen wiederum vermehrt IL-6 frei, sodass ein pathogenetischer Rückkopplungsmechanismus entsteht [2, 3, 4].
Die Wirkung von IL-6 wird sowohl durch membrangebundene (mIL-6R) als auch lösliche Rezeptoren (sIL-6R) vermittelt. Bei der rheumatoiden Arthritis spielt die IL-6-Signaltransduktion eine zentrale Rolle und ist mit mehreren physiologischen Effekten assoziiert, die systemisch umfassend zur Pathogenese der rheumatoiden Arthritis beitragen (Abb. 1).
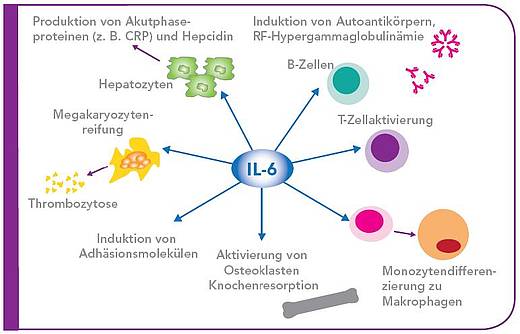
Diese physiologischen Effekte von IL-6, die umfassend zur Pathogenese der RA beitragen, bestehen in:
- Der Aktivierung von Osteoklasten, die bei der Vermittlung der Knochenzerstörung bei der RA eine zentrale Rolle spielen [4, 6, 8, 9]; überhöhte IL-6-Spiegel tragen neben der Knochenresorption auch zur Entwicklung einer systemischen Osteoporose, einer bekannten Spätkomplikation der RA, bei. Auch die Funktion der Osteoblasten, die für die Knochenbildung entscheidend ist, kann durch IL-6 gehemmt werden [10].
- Der Stimulation der Produktion von Akutphaseproteinen in der Leber, die mit einer systemischen Entzündung einhergeht [2, 4].
Die Akutphaseproteine umfassen- das C-reaktive Protein (CRP), das bei der RA üblicherweise als Surrogatmarker für eine systemische Entzündung verwendet wird [11] und
- Hepcidin, ein Schlüsselregulator des Eisenstoffwechsels [12]. Hepcidin supprimiert die Expression des Eisentransporters Ferroportin-1 und hemmt auf diese Weise die Absorption und die Freisetzung von Eisen. Dies begünstigt die Entwicklung einer Anämie und erklärt die bei vielen Patienten auftretende Müdigkeit sowie das Gefühl der Erschöpfung und Leistungseinschränkung [13].
Die Produktion der Akutphaseproteine spiegelt sich auch in der Zunahme der Blutsenkungsgeschwindigkeit (BSG) wieder, die bei Patienten mit RA beobachtet werden kann und einen weiteren unspezifischen Marker der Entzündungsreaktion darstellt [11, 14].
- Der Induktion der Differenzierung von B-Zellen zu antikörperproduzierenden Plasmazellen. Dies kann zur Steigerung der Produktion von Autoantikörpern -wie z. B. dem Rheumafaktor - führen, die körpereigene Zellen für eine Immunattacke durch Makrophagen markieren [4].
- Der Förderung einer Aktivierung und nachfolgender Differenzierung von T Zellen.
Aktuelle Studien bringen IL-6 mit der bevorzugten Differenzierung von T-Zellen zu pathogenen TH17-Zellen in Verbindung, die zulasten der protektiven regulatorischen T-Zellen eine entscheidende Rolle bei der Induktion einer autoimmunen Gewebeschädigung spielen [15,16]. - Der Steigerung der Leukozytenrekrutierung durch Induktion einer Subgruppe von Chemokinen in Endothelzellen sowie der verstärkten Expression von Adhäsionsmolekülen [17].
- Der Förderung der Reifung von Megakaryozyten zu Thrombozyten und damit die potentielle Induktion einer Thrombozytose [8]. IL-6 spielt daher bei der chronischen Entzündung und Autoimmunität im Rahmen der RA sowohl auf lokaler als auch auf systemischer Ebene eine fundamentale Rolle.
Literatur
Madhok R, et al. Serum interleukin 6 levels in rheumatoid arthritis: correlations with clinical and laboratory indices of disease activity. Ann Rheum Dis 1993; 52:232–234.
Choy E. Interleukin 6 receptor as a target for the treatment of rheumatoid arthritis. Ann Rheum Dis 2003; 62 Suppl 2:ii68–ii69.
Heinrich PC, et al. Interleukin-6-type cytokine signalling through the gp130/Jak/STAT pathway. Biochem J 1998; 334 (Pt 2):297–314.
Choy E. Clinical experience with inhibition of interleukin-6. Rheum Dis Clin North Am 2004; 30:405–15,
Smolen JS, Steiner G. Therapeutic strategies for rheumatoid arthritis. Nat Rev Drug Discov 2003;2:473–488.
Firestein GS. Evolving concepts of rheumatoid arthritis. Nature 2003; 423:356–361.
Smolen JS, et al. New therapies for treatment of rheumatoid arthritis. Lancet 2007; 370:1861–1874
Yoshizaki K, et al. Therapy of rheumatoid arthritis by blocking IL-6 signal transduction with a humanised anti-IL-6 receptor antibody. Springer Semin Immunopathol 1998; 20:247–259.
12 Kotake S, et al. Interleukin-6 and soluble interleukin-6 receptors in the synovial fluids from rheumatoid arthritis patients are responsible for osteoclast-like cell formation. J Bone Miner Res 1996; 11:88–95
De Benedetti F, et al. Impaired skeletal development in interleukin-6-transgenic mice: a model for the impact of chronic inflammation on the growing skeletal system. Arthritis Rheum 2006; 54:3551–3563.
Ranganath VK, et al. Age adjustment corrects for apparent differences in erythrocyte sedimentation rate and C-reactive protein values at the onset of seropositive rheumatoid arthritis in younger and older patients. J Rheumatol 2005; 32:1040–1042.
Nemeth E, et al. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest 2004; 113:1271–1276.
Voulgari PV, et al. Role of cytokines in the pathogenesis of anemia of chronic disease in rheumatoid arthritis. Clin Immunol 1999; 92:153–160.
Akira S, et al. Interleukin-6 in biology and medicine. Adv Immunol 1993; 54:1–78.
Mangan PR, et al. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature 2006; 441:231–234.
Bettelli E, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T-cells. Nature 2006; 441:235–238.
Romano M, et al. Role of IL-6 and its soluble receptor in induction of chemokines and leukocyte recruitment. Immunity 1997; 6:315–325.
Brennan FM, McInnes IB. Evidence that cytokines play a role in rheumatoid arthritis. J Clin Invest 2008;118:3537–45.
Robak T, et al. Serum levels of interleukin-6 type cytokines and soluble interleukin-6 receptor in patients with rheumatoid arthritis. Med Inflammation 1998;7:347–53.
