Wechselwirkung mit anderen Medikamenten
Da Anakinra ein langwirksames Antirheumatikum ist, wird es im Regelfall zusammen mit Medikamenten aus der Gruppe der cortisonfreien Entzündungshemmer und ggf. auch zusammen mit Cortison eingesetzt. Auf der Basis der in Deutschland gültigen Zulassung erfolgt die Anakinra-Behandlung darüber hinaus üblicherweise als Kombinationstherapie zusammen mit Methotrexat.
Wechselwirkungen zwischen Anakinra und den genannten Medikamenten sind nicht bekannt. Allerdings liegen für die meisten dieser Substanzen keine Daten aus speziellen Untersuchungen vor.
Studienergebnisse von Experimenten an Ratten zeigen allerdings speziell für Methotrexat, dass sich die beiden Substanzen gegenseitig im Hinblick auf ihre wesentlichen pharmakologischen und toxikologischen Eigenschaften nicht beeinflussen (z.B. Ausscheidung aus dem Körper oder Nebenwirkungen).
In den vorliegenden klinischen Studien wurden Wechselwirkungen von Anakinra mit anderen Arzneimitteln nicht beobachtet, insbesondere auch nicht mit cortisonfreien Entzündungshemmern (NSAR), Cortison oder langwirksamen Antirheumatika (DMARDs).
Auf die besondere Situation im Hinblick auf TNF-alpha-Blocker wurde bereits oben näher eingegangen. Vergleiche zur Kombination mit TNF-alpha-Blockern auch den Abschnitt über den Einsatz von Kineret in der Kombinationstherapie.
Die Sicherheit von Anakinra (Handelsname: Kineret) wurde in 3 randomisierten, placebo-kontrollierten Studien mit insgesamt 2.932 Patienten mit rheumatoider Arthritis (chronischer Polyarthritis) und in einer speziellen Studie zur Langzeitanwendung in der täglichen Praxisroutine überprüft.
Auf die in allen genannten Studien beobachteten wichtigsten Nebenwirkungen wird im Folgenden detailliert eingegangen.
Hautreaktionen im Bereich der Injektionsstellen
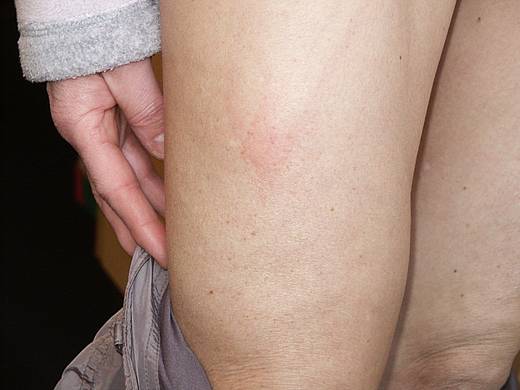
In allen placebo-kontrollierten Studien zu Anakinra bei rheumatoider Arthritis (RA) war die häufigste Nebenwirkung von Anakinra eine Hautreaktion im Bereich der Injektionsstelle. Hautreaktionen wurden in den placebo-kontrollierten klinischen Studien zur RA bei bis zu 71% der Patienten beobachtet (allerdings auch bei bis zu 28% der Patienten, die lediglich Placebo erhielten). Interessanterweise, lag die Rate der Hautreaktionen in CAPS-Studien nur bei 20-40 %. Bei der überwiegenden Zahl der Patienten (ca. 95%) waren die Reaktionen mild bis mäßig stark ausgeprägt. Sie äußerten sich als Rötungen, kleine Einblutungen und oberflächliche Entzündungen und gingen teilweise mit Juckreiz und / oder Schmerzen einher.
Bei den Hautreaktionen handelt es sich zum Teil um kleinflächige, zum Teil auch um großflächige Rötungen, die unterschiedlich intensiv ausgeprägt sind. Bei einigen Patienten kommt es auch zu erheblichen Schwellungen. Nach einer Injektion reagieren "alte" Injektionsstellen häufig mit, d.h. es kommt zum Auftreten von Rötungen und Entzündungen an Stellen, an denen die Tage vorher die Injektion verabreicht wurde. Dieses Phänomen wird auch als "Recall-Phänomen" bezeichnet.
Beispiele für typische Hautreaktionen unter einer Therapie mit Anakinra zeigt die Abbildung von Injektionsstellen im Bereich des Oberschenkels:
Der Ursache dieser Hautreaktionen wurde erst kürzlich genauer nachgegangen: Demnach führen die Zusammensetzung der Injektionslösung und eine höhere Proteinkonzentration zur Degranulation von Mastzellen (Freisetzung von Histamin) nach subkutaner Injektion (Kaiser et al 2012). Mögliche Ursachen für den Injektionsschmerz können in Zusammenhang mit dem Citratpuffer, dem nicht physiologischen pH und Polysorbat 80 stehen. Möglicherweise handelt es sich um eine Art allergischer Reaktion ("pseudoallergische" Reaktion) auf den Trägerstoff, in dem die Substanz gelöst ist. Dafür spricht, dass die Reaktionen mit der Gabe eines Antihistaminikums (s.u.) unterdrückt werden können.
Man teilt diese Hautreaktionen heute in eine sofortige und eine verspätete Reaktion ein. Meistens muss gegen die Hautreaktionen nichts unternommen werden. Sollte es dennoch erforderlich sein, kann die verspätete Reaktion oft schon mit örtlichen Maßnahmen gelindert werden, z.B. durch Kühlen, u.U. auch durch Auftragen von Salben, die Cortison oder ein sogenanntes Antihistaminikum enthalten. Antihistaminika sind Medikamente, die man gegen Entzündungen einsetzt, die durch den körpereigenen Stoff Histamin vermittelt werden, der u.a. auch eine Rolle bei anderen allergischen Reaktionen wie Heuschnupfen oder allergischer Bindehautentzündung spielt. Manchmal ist auch der Einsatz eines Antihistaminikums in Tablettenform sinnvoll.
Kommt es akut nach der Injektion zu Schmerzen, Brennen oder Rötungen an der Einstichstelle hilft Kühlen. Außerdem sollte bei der nächsten Injektion darauf geachtet werden, dass die Stelle vor und nach der Injektion 2-3 Minuten gekühlt wird und dass die Spritze auf Raumtemperatur gebracht wird, siehe dazu unsere praktischen Tipps zur Injektionstechnik.
Je nach Lage der Dinge und in Absprache mit dem behandelnden Arzt muss bei heftigeren Injektionsreaktionen u.U. die Therapie auch für einige Tage ausgesetzt werden. Normalerweise zwingen die Hautreaktionen nicht zu einem endgültigen Abbruch der Therapie. In den klinischen RA-Studien war dies nur bei 7% der Patienten der Fall. In CAPS-Studien brach kein Patient die Behandlung mit Kineret aufgrund von Reaktionen an der Einstichstelle ab.
Bleibende Schäden am Ort der Injektionsreaktionen sind nicht zu erwarten. Zumindest sind aus allen bisherigen Studien keine entsprechenden Langzeitfolgen bekannt.
Wichtig ist, dass die beschriebenen Hautreaktionen kein Warnhinweis für schwere, "allergische" Allgemeinreaktionen oder schwere Überempfindlichkeitsreaktionen sind (sogenannte anaphylaktische Reaktionen, die durch schwere Herz-Kreislauf-Reaktionen bis hin zum anaphylaktischen Schock gekennzeichnet sind und die unter einer Therapie mit Anakinra nur extrem selten auftreten).
Injektionsreaktionen treten unter Anakinra treten üblicherweise innerhalb der ersten 4 Wochen auf, in der Regel zwischen dem 10. und 12. Tag nach Therapiebeginn (im Median am 11. Tag). Sie dauern normalerweise für 14 bis maximal 28 Tage an und verschwinden anschließend. Das Auftreten von Hautreaktionen nach Ablauf des ersten Monats war in den klinischen Studien extrem selten. Patienten, die im ersten Monat keine Injektionsreaktionen entwickeln, werden mit hoher Wahrscheinlichkeit im Laufe der weiteren Therapie ebenfalls keine solchen Reaktionen erfahren.
Infektionen
In den klinischen Studien war die Häufigkeit von Infektionen unter einer Anakinra-Therapie insgesamt nur geringfügig erhöht (40% in der Anakinra-Gruppe gegenüber 35% in der Placebo-Gruppe). Am häufigsten kam es zu Infektionen im Bereich der oberen Luftwege und des Nasen-Rachen-Raums sowie zu grippeartigen Symptomen.
Die Rate an schwerwiegenden Infektionen war insgesamt niedrig. Bei den mit Anakinra behandelten Patienten war sie mit knapp 2% aller Patienten etwas höher im Vergleich zur Placebogruppe, bei der schwere Infektionen bei etwas weniger als 1% der Patienten beobachtet wurden (1.8% vs. 0.6%).
Die schwereren Infektionen manifestierten sich in erster Linie als bakterielle Infektionen, z.B. des Unterhautfettgewebes (Cellulitis), als Lungenentzündung (Pneumonie) sowie als bakterielle Infektionen im Bereich der Knochen und Gelenke. Sogenannte "opportunistische" Infektionen, wie sie bei Patienten mit einer stark gestörten Immunabwehr auftreten, waren selten.
Patienten mit Asthma hatten ein höheres Risiko für Infektionskomplikationen (5% in der Anakinra-Gruppe gegenüber <1% in der Placebo-Gruppe).
Bei den meisten Patienten konnte die Therapie nach erfolgreicher Behandlung der Infektionskomplikation fortgesetzt werden. Bei keinem der in den Studien mit Anakinra behandelten Patienten kam es in der Folge der Infektion zu einem tödlichen Ausgang.
Eine Sondersituation liegt für die Kombinationstherapie mit TNF-alpha-Blockern vor. Außerhalb der genannten großen Studien wurde die Kombination von Anakinra mit Etanercept in einer sehr kleinen Pilotstudie mit 58 RA-Patienten über 24 Wochen geprüft. Dabei war die Rate von schwerwiegenden Infektionen mit 7% (4/58 Patienten) doch ganz beträchtlich (2 Patienten mit bakterieller Pneumonie; 2 Patienten mit Cellulitis). Bei allen 4 Patienten konnten die Infektionen durch eine antibiotische Therapie folgenlos beseitigt werden.
Verminderung der Zahl von weißen Blutkörperchen (Neutropenie)
Bei den mit Anakinra behandelten Patienten kam es etwas häufiger als in der Placebo-Gruppe zu einer Verminderung der Zahl von weißen Blutkörperchen (Leukopenie, Neutropenie). In der Regel war diese nicht stark ausgeprägt und ging dann auch nicht mit einem erhöhten Infektionsrisiko einher. Weitere mögliche hämatologische Nebenwirkungen betrafen eine leichte Verminderung der Zahl von Blutplättchen (Thrombozyten) und einen leichten Anstieg in der Zahl der sogenannten eosinophilen Granulozyten (eine Untergruppe der weißen Blutkörperchen, Eosinophile).
In den placebo-kontrollierten Studien kam es bei 8% der Anakinra-Patienten zu einer leichtgradigen Leukopenie (Grad 1 nach der Einteilung der WHO; WHO = World Health Organisation, Welt-Gesundheits-Organisation). 6 Patienten (0,3%), die mit Anakinra behandelt wurden, entwickelten eine höhergradige Leukopenie mit Neutrophilen-Werten von < 1 x 109/L.
In der Kombination mit Etanercept ist das Risiko für die Entwicklung einer höhergradigen Neutropenie offensichtlich höher. In der genannten Pilotstudie wurde diese Komplikation bei 3% (2/58 Patienten) beobachtet. Bei diesen Patienten traten im Rahmen der Neutropenie auch Infektionskomplikationen auf (in einem Fall eine Cellulitis, in einem weiteren Fall eine Pneumonie). Bei beiden Patienten konnte diese Infektionskomplikation durch eine antibiotische Therapie erfolgreich kontrolliert werden.
Antikörperbildung
Bei einem Teil der Patienten kommt es zu einer Antikörperbildung gegen die Wirksubstanz Anakinra, die die Wirkung allerdings in der Regel nicht beeinträchtigt. Der positive Antikörpernachweis hängt sehr von der verwendeten Methode ab. In einem sehr empfindlichen Biosensor-Assay waren Antikörper bei 21-34% der Patienten nachweisbar. In einem Bioassay auf zellulärer Grundlage wurden neutralisierende Antikörper dagegen bei weniger als 1% der Patienten gefunden (9/1.274 getesteten Patienten). Bei keinem der mit diesem Assay getesteten Patienten war dabei der Antikörpernachweis zu mehr als einem Zeitpunkt positiv. Eine Korrelation zur Wirksamkeit bzw. Unwirksamkeit von Anakinra wurde nicht beobachtet. Insgesamt scheint eine Antikörperbildung gegen die Wirksubstanz im Falle von Anakinra keine klinisch relevante Rolle zu spielen.
Tumorrisiko
Nach den Daten der vorliegenden Studien besteht unter einer Therapie mit Anakinra kein erhöhtes Tumorrisiko. Entsprechende Daten liegen aus den Studien für 2.531 Patienten mit rheumatoider Arthritis und Beobachtungszeiträume von bis zu 50 Monaten vor. In diesem Zeitraum traten in der Studiengruppe bei 22 Patienten bösartige Tumoren verschiedener Art auf. Diese Tumorrate entspricht der Häufigkeit, die auch für eine vergleichbare, unbehandelte Personengruppe zu erwarten wäre.
Überempfindlichkeitsreaktionen (allergische Reaktionen, anaphylaktische Reaktionen)
Da es sich bei Anakinra um ein Eiweißprodukt handelt, sind grundsätzlich Überempfindlichkeitsreaktionen denkbar. Das Risiko solcher Reaktionen ist allerdings sehr niedrig, da Anakinra dem im menschlichen Körper vorkommenden natürlichen IL-1-Rezeptorantagonisten weitgehend entspricht. Weiterhin denkbar sind Überempfindlichkeitsreaktionen auf die Trägerlösung oder Bestandteile des Medikaments.
In der klinischen Studien wurden schwere Überempfindlichkeitsreaktionen sehr selten beobachtet. Sie äußerten sich entweder lokal in Form von starken Hautschwellungen oder ausgeprägten Hautrötungen oder systemisch in Form von allgemeinen Überempfindlichkeitsreaktionen wie Atemnot, Blutdruckabfall und ausgeprägten Herz-Kreislauf-Reaktionen bis hin zum Schock. Meistens beschränkten sich allergische Reaktionen jedoch auf stippchenartige oder brennesselartige Hautausschläge. Wenn es zu schweren Überempfindlichkeitsreaktionen kommt, ist neben den notwendigen Sofortmaßnahmen ein Absetzen der Anakinra-Therapie nötig.
Nebenwirkungen im Bereich der inneren Organe
Gefährliche Nebenwirkungen im Bereich der inneren Organe wie eine Schädigung von Leber oder Nieren sind vom theoretischen Ansatz her bei einer Therapie mit Anakinra nicht zu erwarten. Entsprechend wurden solche Nebenwirkungen in den vorliegenden klinischen Studien auch nicht beobachtet.
Unsere Seiten zu Anakinra (Kineret)
Kurzbeschreibung
Anwendungsgebiete
Praktische Durchführung
Impfungen, Schwangerschaft und Stillzeit
Praktische Tipps
Literatur
Fleischmann RM, Schechtman J, Bennett R, et al. Anakinra, a recombinant human interleukin-1 receptor antagonist (r-metHuIL-1ra), in patients with rheumatoid arthritis: a large, international, multicenter, placebo-controlled trial.
Arthritis Rheum. 2003; 48, 927–94Cohen S, Hurd E, Cush J, et al. Treatment of rheumatoid arthritis with anakinra, a recombinant human interleukin-1 receptor antagonist, in combination with methotrexate: results of a twenty-four-week, multicenter, randomized, double-blind, placebo-controlled trial.
Arthritis Rheum 2002; 46: 614-24Jiang Y, Genant HK, Watt I, et al. A multicenter, double-blind, dose-ranging, randomized, placebo-controlled study of recombinant human interleukin-1 receptor antagonist in patients with rheumatoid arthritis: radiologic progression and correlation of Genant and Larsen scores.
Arthritis Rheum 2000; 41: 2196-204Schiff MH, DiVittorio G, Tesser J, et al. The safety of anakinra n high-risk patients with active rheumatoid arthritis. six-month observations of patients with commorbid conditions.
Arthritis Rheum 2004; 50: 1752-60Singh JA, Wells GA, Christensen R, Tanjong Ghogomu E, Maxwell L, MacDonald JK, Filippini G, Skoetz N, Francis D, Lopes LC, Guyatt GH, Schmitt J, La Mantia L, Weberschock T, Roos JF, Siebert H, Hershan S, Lunn MPT, Tugwell P, Buchbinder R. Adverse effects of biologics: a network meta-analysis and Cochrane overview (Review)
Cochrane Database Syst Rev. 2011 Feb 16;(2):CD008794Kaiser C, Knight A, Nordström D, Pettersson T, Fransson J, Florin-Robertsson E, Pilström B Injection-site reactions upon Kineret (anakinra) administration: experiences and explanations.
Rheumatol Int. 2012 Feb;32(2):295-9. doi: 10.1007/s00296-011-2096-3. Link