Anakinra (Handelsname: Kineret) wurde zunächst für die Behandlung der rheumatoiden Arthritis (chronischen Polyarthritis) entwickelt und für diese Anwendung umfassend klinisch erprobt. Mit der Charakterisierung von Cryopyrin-Assoziierten Periodischen Syndromen (CAPS) als Interleukin-1-getriebenen Erkrankungen erweiterte sich die klinische Forschung um den Einsatz von Anakinra bei diesen Krankheitsbildern.
Anwendung von Anakinra bei der rheumatoiden Arthritis
Die offizielle Zulassung ist in den Vereinigten Staaten und in Europa unterschiedlich; die Unterschiede beziehen sich vor allem auf die Frage der Monotherapie bzw. der Kombination mit Methotrexat (vgl. dazu unsere Seite zur Wirksamkeit).
In den USA erfolgte die Zulassung von Anakinra durch die FDA (Food and Drug Administration) mit Datum vom 16. November 2001. Nach dem dortigen Zulassungstext ist die Behandlung mit Anakinra angezeigt
"zur Reduktion der Krankheitszeichen und Symptome einer mittelgradig bis hoch aktiven rheumatoiden Arthritis bei Patienten von 18 Jahren oder älter, bei denen eine vorhergehende Therapie mit mindestens einem langwirksamen Antirheumatikum (DMARD) nicht angesprochen hat. Kineret kann in den USA als Monotherapie oder in Kombination mit anderen DMARDs mit Ausnahme von TNF-Blockern eingesetzt werden" [Verlinkungen durch den Verfasser]
(Originaltext: "Kineret is indicated for the reduction in signs and symptoms of moderately to severely active rheumatoid arthritis, in patients 18 years of age or older who have failed 1 or more disease modifying antirheumatic drugs (DMARDs). Kineret can be used alone or in combination with DMARDs other than Tumor Necrosis Factor (TNF) blocking agents").
In Europa und damit auch in Deutschland wurde die Zulassung für Anakinra am 8. März 2002 von der europäischen Zulassungsbehörde EMEA zur Therapie von Patienten erteilt, die nicht ausreichend auf eine vorausgegangene Behandlung mit Methotrexat (MTX) angesprochen hatten (Zusammenfassung, PDF). Anakinra wird bei diesen Patienten in Kombination mit Methotrexat verwendet.
Grundsätzlich kommt damit eine Therapie mit Anakinra bei uns für solche Patienten in Frage, die an einer aktiven rheumatoiden Arthritis leiden und bei denen die Erkrankung unter einer laufenden Behandlung mit Methotrexat nicht ausreichend kontrolliert ist (zur Abschätzung der Aktivität einer rheumatoiden Arthritis ist die von rheuma-online entwickelte online-Version des DAS = disease activity index = Krankheits-Aktivitäts-Index gut geeignet).
Da in den Vereinigten Staaten Anakinra allerdings auch für die Monotherapie der rheumatoiden Arthritis (chronischen Polyarthritis) zugelassen ist, d.h. als alleiniges krankheitskontrollierendes Medikament auch ohne die Kombination mit Methotrexat, ist diese Anwendung auch bei uns unter bestimmten Bedingungen möglich. Ebenso gibt es in Einzelfällen die Möglichkeit, Anakinra auch bei Patienten einzusetzen, bei denen vorher z.B. wegen Anwendungsbeschränkungen ("Kontraindikationen") noch keine Methotrexat-Therapie durchgeführt wurde.
In Deutschland ist Anakinra seit dem 1. April 2002 in den Apotheken erhältlich.
Anwendung von Anakinra bei Cryopyrin-Assoziierten Periodischen Syndromen (CAPS)
Im Dezember 2012 erhielt Kineret (Anakinra) von der US-amerikanischen Zulassungsbehörde FDA (Federal Drug Admininstration) die Zulassungserweiterung für eine Gruppe sehr seltener Krankheitsbilder, die sogenannten NOMID/CINCA-Syndrome (Neonatal-Onset-Multisystem Inflammatory Disease bzw. Chronisches infantiles neuro-kutaneo-artikuläres Syndrom). Mit dieser Zulassungserweiterung war Kineret das erste und einzige von der FDA zugelassene Präparat für diese Erkrankungen.
Die europäische Zulassungsbehörde EMA (European Medicines Agency) erteilte Kineret am 20.11.2013 die Zulassungserweiterung für die Behandlung der sogenannten Cryopyrin-Assoziierten Periodischen Syndrome (CAPS). CAPS schließt die NOMID- und CINCA-Syndrome ein, umfasst aber zusätzlich zwei weitere, ebenfalls sehr seltene Krankheitsbilder, nämlich das Muckle-Wells-Syndrom und das Familiäre Kälte-Autoinflammatorische Syndrom (Familiar Cold Autoinflammatory Syndrome, FACS). Die EMA-Zulassung geht damit über die FDA-Zulassung hinaus, d.h. auch für die Anwendung bei den Cryoprin-Assoziierten Periodischen Syndromen (CAPS) ist die offizielle Zulassung in den Vereinigten Staaten und in Europa unterschiedlich.
Mit der Zulassung für CAPS bezieht sich die Zulassung von Anakinra nun auch auf die Anwendung bei Kindern und Säuglingen ab 8 Monaten mit einem Körpergewicht von mindestens 10 kg. Zugleich erfolgt die Dosierung bei diesen Krankheitsbildern nicht nach einem starren Dosisschema (bei der rheumatoiden Arthritis werden kontinuierlich 100 mg pro Tag injiziert), sondern mit Anpassung an das Körpergewicht, an das klinische Bild und den jeweiligen Bedarf, der sich an dem Entzündungsstatus orientiert (siehe Abbildung).
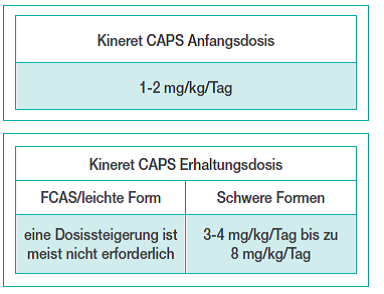
Für die entsprechend notwendigen flexiblen Dosierungen wurde eine neue Fertigspritze mit einer Skale entwickelt, die mit der Zulassung für die CAPS-Therapie die früheren Fertigspritzen abgelöst hat. Für die Behandlung von CAPS ist ausschließlich diese sogenannte graduierte Spritze zu verwenden, welche seit dem 01.07.2014 auf dem deutschen Markt verfügbar ist.
Zur Optimierung einer wirksamen und sicheren Anwendung von Kineret werden CAPS-spezifische Informationsmaterialen für Ärzte und Patienten zur Verfügung gestellt. Diese können vom behandelnden Arzt per Fax (06103 20269-26) oder E-Mail (caps_informationsmaterial@sobi.com) angefordert werden. Die Materialien sind verpflichtender Teil der CAPS-Zulassung und müssen jedem Arzt, der CAPS-Patienten mit Kineret® behandelt, und jedem CAPS-Patienten, der mit Kineret® behandelt wird, zur Verfügung gestellt werden.
